Publikálva:
Lőrincz, A. – Neményi, M. (2002): Az in vitro sejtfeltárás hatékonyságát befolyásoló fizikai tényezők (2. rész). Laboratóriumi Információs Magazin, Biofizika rovat. XI. évfolyam, No. 2. pp. 36-38.
Az in vitro sejtfeltárás
hatékonyságát befolyásoló fizikai tényezők
Felhasznált anyagok és
módszerek
A felhasznált anyagok és
eszközök három csoportra bonthatóak A, az alkalmazott
kezelő berendezések, B, vizsgált szuszpenzió és C, a detektálási rendszerek,
melyeket az 1. ábra mutat sematikusan.
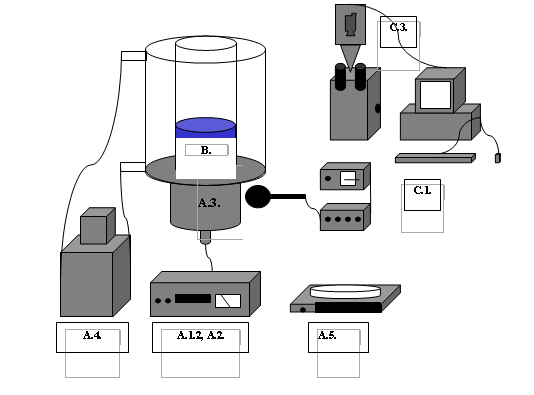
1. ábra: A felhasznált anyagok és
eszközök: A.1., A.2. ultrahang
frekvencia generátor és erősítő, A.3. ultrahang
rezonátor, A.4. termosztát, A.5. analitikai
mérleg, B. kísérleti szuszpenzió, C.1. audio detektor
egység, C.3. biológiai
detektor egység.
Az 1. ábrán látható
műszerek és berendezések részei az „A.1.”
ultrahang frekvencia előállító készülék, melynek jelgeneráló egysége szinusz
jelformát állít elő, 1 [kHz] – 16 [MHz] frekvencia
tartományban, mely 1 [kHz] frekvencia tartományonként történő manuális
frekvenciaállítási lehetőséget biztosít. A készülék az aktuálisan alkalmazott
frekvencia értéket egy monitor egységen jelzi ki. Az „A.2.”
ultrahang erősítő, főleg a megahertzes frekvencia tartományokra tervezett, de
100 [kHz] – 2 [MHz] frekvencia tartományban
viszonylag jó közelítéssel lineáris, azonos mértékű erősítési szintet ad. Az 50
[Ω] impedancia érték mellett 0-40 [W] erősítést tesz lehetővé, valamint az
erősítés mértékét egyenfeszültségben adja meg, melyet kalibrációs görbe
segítségével és a sugárzási felület ismeretében [W/cm2] értékre
tudunk vonatkoztatni. A vizsgálatainkban folyamatos hullám (CW) módot
alkalmaztunk, a célszerűen tervezett rezonátorunkból adódóan legfőbbképpen
longitudinális hullámformát előállítva. A rezonátor kialakítása kiválóan
alkalmas az álló és a haladó sík hullámok kialakítására, így a szuszpenzióban
található részecskék célirányos manipulációjára, illetve inaktiválására is.
A tömeg mérésére az 1.
ábrán „A.4.” jelzésű analitikai mérleget
alkalmaztuk. A besugárzott szuszpendáló anyagként „B” 0,5-1 órán át, pihentetett, 20 [ºC]
hőmérsékletű csapvizet alkalmaztunk, szuszpendált anyagként liofilizált Saccharomyces cerevisiae
élesztőt használtunk. Az alkalmazott detektálási rendszerek „C” több
módszer eszközeit foglalják magukban, ezzel kapcsolatban megkülönböztethetjük a
„C.1.” audio, „C.2.”
vizuális és a „C.3.” biológiai detektálási módszerek eszközeit és
berendezéseit. Az audionális módszer eszközeinek „C.1.” alkalmazásával cél főleg a tranziens kavitáció jellegzetes sziszegő, pattogó hangjának
detektálása audionális módszerekkel, melynek fő
részei a mikrofon és oszcilloszkóp. A „C.2.” vizuális módszer azt
jelenti, hogy a szemmel követhető hullámjelenségeket, a kezelési idő
függvényében folyamatosan nyomon kísérjük, ami például az álló hullám, vagy a
gomolygó áramlás, vagy a folyadék sugár kialakulása lehet, a tapasztalt
jelenségeket az idő függvényében pedig dokumentáljuk.
A „C.3.” biológiai módszer a vitális festés metilénkék festékkel. Célunk a módszer felhasználásával az
ultrahang hatására a mikroorganizmusok életképességében beállt változások
megfigyelése az alkalmazott kezelési idő függvényében. Az adatrögzítést a
biológiai mikroszkópból egy CCD kamerán keresztül beérkezett kép számítógépes file formátumba történő rögzítése biztosítja.
A kezeléseket 1,117 [MHz] frekvencián 9 [W/cm2] ultrahang
teljesítmény mellett végeztük 20 [˚C] hangtér hőmérséklet mellett 20 [ml] sejtszuszpenzió jelenlétében, 3,2 illetve 7,04 [g/l]
sejtkoncentráció + 3 csepp 1 % koncentrációjú metilénkék
oldat mellett. A kezelési idő során 15 másodpercenként 0,02
ml szuszpenzió mintát vettünk ki automata pipettával steril pipetta heggyel
egy-egy mikroszkóp tárgylemezre, amelyekből később, egy időponthoz tartozó több
látótér leszámolásának átlagaként kaptuk meg az egy időponthoz tartozó relatív
sejtszám értékeket, amit azután táblázatos, illetve grafikonos formában
kiértékeltünk. Ezután vettük fel a különböző szuszpenzió koncentrációkhoz
tartozó túlélési görbéket. A kísérletek folyamán, a hangtérben műszeresen és
érzékszervileg tapasztalt hullámjelenségeket szintén az idő függvényében
dokumentáltuk, majd végül az eredményeket összevetettük.
Eredmények és
értékelésük
A
3. ábrán a jellemző kiindulási állapot látszik, ahol megfigyelhető, hogy a
sejtek legnagyobb hányada vitalitást tükröz, nem színeződött és az élesztőre
jellemző morfológiájú. A 4. ábrán a kezelés alatti állapot látható, ahol már a
sejtek egy része a kezelés hatására elpusztult, lyukas, festődött, a citoplazma
és a sejtszervek nagy része az extracelluláris térbe
áramlottak. Az 5. ábrán pedig a kezelés végső stádiuma
figyelhető meg, ahol az alkalmazott módszer alapján kimondható, hogy az összes
sejt elpusztult.
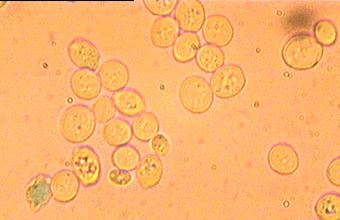
Forrás: Lőrincz Attila, 2001’
2. ábra: kezelés előtti kiinduló
állapot
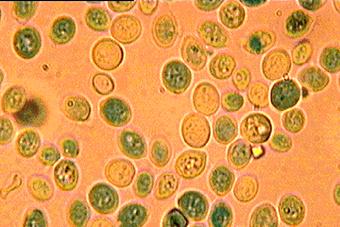
Forrás: Lőrincz Attila, 2001’
3. ábra: kezelés alatti állapot
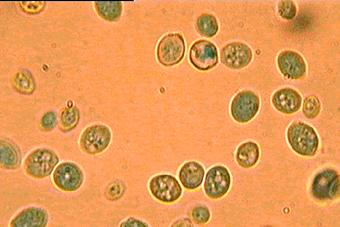
Forrás: Lőrincz Attila, 2001’
4. ábra: a sejtek inaktiválódása
után, a kezelés végső stádiuma,
A
két különböző sejtkoncentráció (3,2 illetve 7,04
[g/l]) mellett tapasztalt túlélési dinamika a 6. ábrán figyelhető meg (1.
táblázat). Jól látszik a két különböző koncentrációhoz tartozó túlélési görbe
közti különbség. Az alacsonyabb sejtkoncentrációhoz tartozó görbe exponenciális
túlélési dinamikát mutat. A második, magasabb sejtkoncentrációjú szuszpenzió
esetében azonban három szakaszt különíthetünk el a túlélési görbében. Az első
szakasz (I) a relatív sejtszám gyors csökkenését mutatja, ahol a haladó
hullám dominál, erős sugárnyomás érvényesül a hangtérben a szemcsék magas
szintű adszorpciója miatt, kavitáció nélkül. Ebben a
szakaszban is csökken a sejtek vitalitása, ezt a szakirodalom is megállapítja.
A második szakaszban (II) a sejtszám csökkenésének megtorpanása
jellemző, ami az állóhullám felépülésének köszönhető. A szuszpendált szemcsék
jól megfigyelhetően az állóhullám nyomási csomósíkjaiban stabilizálódnak. A
harmadik szakaszban (III), az állóhullám hatására létrejött szemcse aggregáció miatti szedimentáció hatására részlegesen letisztult
hangtérben az ultrahang adszorpció csökkenésének hatására megnövekvő akusztikus
nyomás amplitúdó miatt megindul a kavitáció, melynek
zaját detektáltuk. Ebben a szakaszban már szintén exponenciális túlélési
dinamika érvényesül. A hangtér letisztulása, a kiülepedés miatt nem okoz
nagymértékű sejtvédő hatást a kavitációval szemben,
mivel a kavitáció intenzív hangtérbeli
folyadékáramlást indukál, amely hatására a sejtek kavitációs
buborékkal történő találkozása biztosított, így folyamatosan megtörténik az
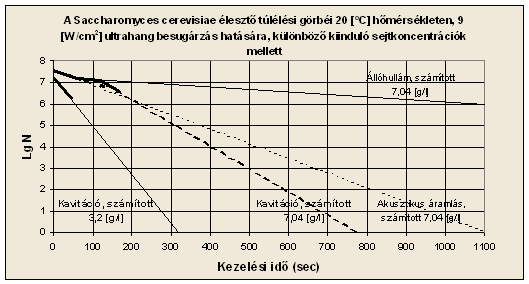
inaktiválódás. Az 7. ábrán, a két
különböző kiinduló sejtkoncentrációjú szuszpenzió túlélési görbéi látszanak.
Megfigyelhető, hogy a két különböző sejtkoncentrációhoz, sőt a magasabb
kiinduló koncentrációjú szuszpenzióban kialakuló eltérő jelenségekhez is,
különböző „D” értékek tartoznak (2. táblázat). Az egyes jelenségek úgy hatnak,
mintha nem ugyanazt a kezelést kapná a két minta. Ez azért van, mivel a
különböző sejtkoncentrációk hatására más-más jelenségek jutnak érvényre a
hangtérben, melyek a most tárgyalt sejtkárosító hatáson túl egyéb hatásokat is
kifejtenek a szuszpendált részecskékre. Az alapanyag 5,6*109
/g kiinduló sejtszámú.
1. táblázat: túlélő sejtszámok alakulása az idő
függvényében
|
Kezelési
idő (sec) |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
150 |
180 |
200 |
240 |
270 |
280 |
|
Átl.
túlélő sejtszám (%) 3,2 [g/l] |
80,25 |
30,5 |
14,8 |
7,25 |
3,75 |
1 |
0 |
|
|
|
|
|
|
|
|
|
|
Átl.
túlélő sejtszám (%) 7,04 [g/l] |
80 |
62 |
39,8 |
34,3 |
30,8 |
30,3 |
29 |
27,8 |
26,5 |
18,5 |
10,5 |
6,5 |
3,75 |
2 |
0,8 |
0 |
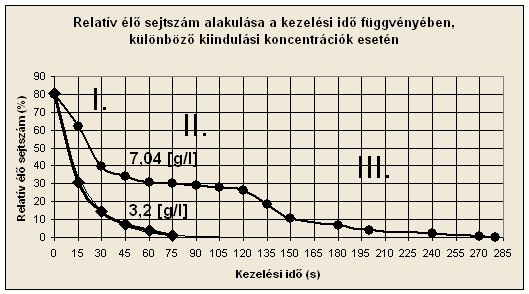
5. ábra: túlélő sejtszámok alakulása az idő
függvényében
6. ábra: a különböző kiinduló koncentrációkhoz tartozó
túlélési görbék
2. táblázat: tizedelődési idők a különböző szuszpenzió
koncentrációk és az eltérő hangtérbeli jelenségek mellett
|
Kiinduló szuszpenzió |
koncentráció |
logN |
Akusztikai jelenség |
D |
|
(g/l) |
N (db/ml) |
|
|
(sec) |
|
3,2 |
1,792*107 |
7,25 |
Kavitáció |
44,05 |
|
7,04 |
3,942*107 |
7,59 |
Akusztikus áramlás |
140 |
|
|
1,516*107 |
7,18 |
Állóhullám |
433 |
|
|
1,304*107 |
7,11 |
Kavitáció |
99 |
Következtetések,
javaslatok
Az
ultrahangtérbeli jelenségek tudatos megválasztásával tehát célirányos
tevékenységet folytathatunk. Azonban az ultrahang felhasználásának akár az
előzőekben ismertetett egyszerű sejtfeltárási felhasználási célhoz szükséges
kísérleti para
Irodalomjegyzék
1. 1. Bíró, I. (1976): Mikrobiológiai
Gyakorlatok. ATE Mezőgazdaságtudományi Kar,
Tejgazdaságtani és Mikrobiológiai Tanszék. P.: 64.
2. 2. Blackshear,
P. L. – Blackshear, G. L. (1987): Mechanical
hemolysis. In: Skalak, R. – Chien, S. eds. Handbook of
bioengineering. New Zork: McGraw-Hill, pp. 15.1-15.9.
3. 3. Brayman,
A. A. – Azadniv, M. –
Miller, M. W. – Chen, X. (1994): Bubble
recycling and ultrasonic cell lysis in a stationary
exposure vessel. J. Acoust. Soc. Am.
Vol. 96. pp. 627-633.
4. 4. Deák, T. (1997): Élelmiszeripari
Mikrobiológia. Kertészeti és Élelmiszeripari Egyetem, Tartósítóipari Kar. Pp.: 51-54.
5. 5. Eckart,
C. (1948): Phys. Rev. 73,
p.68.
6. 6. Frizzel,
L. A. (1988): in Suslick,
S. K. (1988): Ultrasound, Its
Chemical, Phisical, and Biological Effets. VCH Verlagsgesellschaft mbH, Weinheim.
7. 7. Fry, F.
J. (1978): Ultrasound: Its Applications in Medicine and Biology.
Elsevier Scientific Publishing Company, Amsterdam-Oxford-New York.
8. 8. Horbenko,
I. G. (1977): Ultrahang a gépiparban. Műszaki Könyvkiadó, Budapest. p. 186.
9. 9. Gröschl,
M. – Trampler, F. – Benes,
E. – Nowotny, H. (1999): Analysis
os composite resonators for ultrasonic micromanipulation and separation. Acustica – acta acustica 85, Supplement 1, p.
S92, as well as in Journal of
Acoustical Society of America Vol.
105, p. 1018, February 1999.
10. 10.
Liebeskind, D. – Bases, R.
– Elequin, F. – Neubrot, S.
– Leifer, R. – Goldberg, R.
– Koenigsberg, M. (1979): Diagnostic
ultrasound: effects on the DNA and
growth patterns of animals cells.
Radiology. Vol. 131, pp. 177-184.
11. 11.
Loverock, P. – ter Haar, G. (1991): Synergism between hyperthermia, ultrasound and gamma irradiation. Ultrasound in Med & Biol.,
Vol. 17, pp. 607-612.
12. 12.
Lőrincz, A. – Neményi, M.
(2001): Cell decrease by ultrasonic effect
on yeast (Saccharomyces cerevisiae) suspension and the limit concentration of cavitation. Phisical Methods In Agriculture, Praha, Aug. 28-30.
13. 13.
Miller, M. W. – Miller, D. L. – Brayman, A. A. (1996): A review of in vitro
bioeffects of inertial ultrasonic cavitation from a mechanistic perspective. Ultrasound in Med
& Biol., Vol. 22, No.
9, pp. 1131-1154.
14. 14.
Miller, D. L. – Thomas, R. M. (1994): Cavitation dosimerty: estimates for single bubbles
in rotating-tube exposure system. Ultrasound in Med
& Biol., Vol. 20, pp.
197-193.
15. 15.
Suslick, S. K. (1988): Ultrasound,
Its Chemical, Phisical, and Biological
Effets. VCH Verlagsgesellschaft
mbH, Weinheim.
16. 16.
Tar, F. (1982): Ultrahangfizika. Kohó- és Gépipari Továbbképző és Módszertani
Intézet, Budapest.
17. 17.
Tarnóczy, T. (1963): Ultrahangok. Műszaki Könyvkiadó,
Budapest. p.271.
18. 18.
Thacker, J. (1973): An approach the mechanism
of killing cells in suspension
by ultrasound. Biochem. Biophis. Acta. 304, 240.
19. 19.
Veit, I. (1977): Műszaki Akusztika. Műszaki
Könyvkiadó, Budapest. p.: 169.
20. 20.
Walsh, P. – Radel, S.
- McLoughlin, A. J. –Gherardini, L. – Benes, E. (1999): Evaluation of the effect
of immobilisation techniques and low intensity ultrasonic
waves on brewer’s yeast cells. Poster presentation,
to be published in Proc. of
the Ninth European Congress on Biotechnology, Brussels, July 11th – 15th, 1999.