3. Anyag és módszer
3.1. Folyadékáramoltatásos ultrahangrendszer

A folyadékáramoltatásos
ultrahangrendszer létrehozásának az volt a célja, hogy az iparban alkalmazható
folyamatos ultrahangkezelés lehetőségét tanulmányozhassuk (Neményi et al.,
2002). A kísérletek alapanyagaként vízben szuszpendált előzetesen préselt,
kereskedelmi forgalomban kapható Saccharomyces cerevisiae pékélesztő
sejteket használtunk. Az élesztőgomba életképesség változását 1% metilénkék
indikátorral vizsgáltuk az effektív kezelési idő függvényében. A kísérletek 7,5,
9,6, 10,5 és 12W/cm2 kisugárzott ultrahang teljesítmények mellett,
1100kHz ultrahang frekvencián történtek. Így a sejtátmérő-hullámhossz arány
hozzávetőleg 1:100volt, mivel az élesztőgomba megközelítőleg 0,01mm átmérőjű, a
hullámhossz pedig vizes közegben 1,336 mm a fenti frekvencián. Az ultrahang
jelgenerátor a 4. ábrán, az ultrahang erősítő az 5. ábrán látható, melynek
teljesítménye 0-14W között szabályozható 0,7-1,4MHz frekvenciatartományban.


A felerősített nagyfrekvenciás jelet az adó ultrahang sugárzófejben elhelyezett piezoelektromos elem segítségével alakítottuk ultrahanggá, illetve egy másik ultrahang sugárzófej segítségével alakítottuk vissza az ultrahangot elektromos jellé, tehát egy adó és egy vevő sugárzófejet alkalmaztunk. Mindkét ultrahang sugárzófej síkfelületű bárium-titanát piezoelektromos elemet tartalmazott, felületük 1-1cm2 volt. A 6. ábra az ultrahangrendszer elrendezést mutatja. A vevő sugárzófejet oszcilloszkóppal kötöttük össze. A kezeléseket állóhullám elleni adszorberrel borított „visszhangmentes” tartályban végeztük. Az adó és a vevő sugárzófej között ultrahang közvetítő folyadékként, gáztalanított desztillált vizet használtunk. A folyadékáramoltatásos rendszer 4mm belső átmérőjű szilikon csővezetékekből, ultrahangos kezelő küvettából, perisztaltikus szivattyúból és megcsapoló ágból áll, melynek összes belső térfogata 50ml.
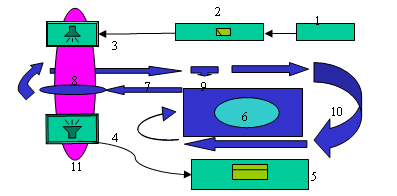
(1. jelgenerátor, 2. ultrahang erősítő, 3. adó sugárzófej, 4. vevő sugárzófej, 5. oszcilloszkóp, 6. perisztaltikus szivattyú, 7. kivezető folyadékág, 8. ultrahangos kezelő küvetta, 9. mintavevő csap, 10. visszavezető folyadékág, 11. visszhangmentes állandó hőmérsékletű tatály)
Az oszcilloszkópot az ultrahangrendszer állandó konfiguráción tartásához használtuk, a reprodukálható kísérleti elrendezés miatt, vagyis azért hogyha egy szerkezeti elemet elmozdítottunk, akkor vissza tudjuk állítani az „eredeti” helyzetébe. Ekkor az adó sugárzófej és a kezelő küvetta helyzetét addig változtattuk, amíg a stabilizált vevő sugárzófej éppen 10mV jelet nem érzékelt, állandó 1W/cm2 kisugárzott intenzitás mellett. Mivel a vevő által vett feszültséget nem lehet objektív módon értékelni kalibráló hidrofon hiányában, ezért a vevőt, az eredmények egymáshoz képest való összehasonlításával, kizárólag a rendszer konfiguráció állandóságának biztosítása érdekében alkalmazhattuk és a küvettába jutó ultrahang effektív sugárzási intenzitását pedig emiatt számítani kellett.
Az 50cm3 belső térfogatú rendszerben (voltak próbálkozások 50, 100 és 200 ml-re) a sejtszuszpenziót perisztaltikus szivattyúval cirkuláltattuk a rendszeregységek között 100mm/sec csőbeli sebességgel, melyet a perisztaltikus szivattyú rotorjának kerületi sebességével állítottunk be. A 4mm belső átmérőjű, vagyis 0,12566cm2 áramlási felületű szilikon csőre vonatkozóan. Ez azt jelenti, hogy a 100mm/sec mellett 1,2566cm3/sec volt a térfogatáram a csőben. Így egy cirkuláció 39,78sec és egy óra alatt 90,49 cirkuláció van.
Az ultrahangos kezelő küvetta (7. ábra) kvarcüvegből készült, falvastagsága 0,1 mm, be- és kiáramlási nyílásai 0,1mm körüli átmérőjűek a folyadék turbulens küvettabeli áramoltatása miatt. A küvettában a folyadékréteg magassága 6mm és a küvetta átmérője 10mm, így belső térfogata 0,471cm3. Az 1,2566cm3/sec folyadékáram mellett a küvettányi folyadékmennyiség cirkulációnkénti tartózkodási ideje 0,3748sec, vagyis óránként (90,49cirkuláció*0,3748sec) 33,91sec az effektív kezelési idő.
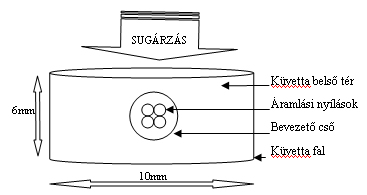
A küvetta és a benne áramló folyadék az ultrahang sugárra merőlegesen volt elhelyezve. Az immerziós látóterek képét, biológiai mikroszkópra szerelt CCD kamerával összekötött digitalizáló számítógéppel rögzítettük. A visszhangmentes kádat LAUDA típusú fűthető-hűthető berendezéssel 20°C állandó hőmérsékleten tartottuk.
3.1.1. A folyadékáramoltatásos kísérletsorozat módszerei, túlélő sejtszám meghatározására
A pékélesztőgombából 1g mennyiséget szuszpendáltattunk 50ml desztillált vízben, mágneses keverővel. A préselt élesztő hozzávetőleg 109/gramm csíraszámú, a minták koncentrációját 2-3*107/ml körülire állítottuk be. Kontrollként Bürker-kamra segítségével sejtszámlálást végeztünk 4 ismétlésben, ismétlésenként 10 cellát leszámolva, majd az eredményeket átlagolva. A szuszpenzióhoz 5csepp 1% metilénkék oldatot cseppentettünk a túlélési dinamika vizsgálata céljából, amely koncentráció, a kontroll vizsgálatok alapján nem befolyásolta az élesztősejtek vitalitását.
Az előkészített 200C hőmérsékletű szuszpenziót folyamatos keverés mellett a folyadékáramoltatásos rendszer bevezető ágán keresztül a rendszerbe áramoltattuk. Ezután rövidre zártuk a rendszert, amitől kezdve cirkuláció folyt a csövekben, majd bekapcsoltuk az oszcilloszkópot és kicsatoltuk az ultrahangot.
A folyadékáramoltatásos rendszer rövidre zárása után és az ultrahangrendszer bekapcsolásától kezdődően az ultrahang sejtroncsoló hatását a megcsapoló ágból vett minták immerziós objektív alatti adott effektív kezelési időpillanathoz tartozó átlagos relatív élő sejtszámának és a kiinduló abszolút élősejtszámnak az ismeretéből kaptuk. Az idő függvényében vett minták mennyisége egyenként legalább 15μl volt, melyből legalább 15 immerziós látótér leszámolásának átlagából kaptuk a relatív élősejtszámot.
Az egyes effektív kezelési időpillanatokhoz tartozó relatív élősejtszám értékekből az abszolút élősejtszámok ismeretében Deák (1997) szerint meghatároztuk a tizedelési időintervallumot minden kezelt mintára. Ebből pedig meghatároztuk a túlélési, a rezisztencia és a pusztulási görbéit az élesztőgombának és a tizedelési időintervallumok egy nagyságrenddel történő megváltoztatásához szükséges teljesítményváltozás mértékét.
3.1.2. A kezelés definíciója
Kezelésnek tekintettük azt az időtartamot, amely során a folyadékáramoltatásos rendszerben keringetett sejtszuszpenziót meghatározott ideig, meghatározott teljesítményű ultrahanghatásnak vetettük alá. A kezelési időn az ultrahang bekapcsolásától, annak leállításig eltelt időt értjük (Lőrincz & Neményi, 2003b).
3.1.3. A célobjektumhoz jutó ultrahang intenzitás meghatározása
Célunk a küvettában lévő sejtszuszpenzióhoz jutó intenzitás meghatározása. Tarnóczy (1963) a folyadékba merülő, folyadéktól eltérő akusztikai keménységű lemezre vonatkozóan határozta meg a reflexiót, vagy visszaverődési fokot Eszerint:
R=((q2-1)2)/((q2+1)2+4q2ctg2(2πd/λ)) [13].
q=(ρ2*c2)/(ρ1*c1) [14].
z= ρ*c [15].
Ahol (R) a visszaverődési fok (z) az akusztikai keménység, (q) a két közeg akusztikai keménységének hányadosa, (d) a lemez vastagsága, (λ) a lemezben kialakuló hullámhossz, (ρ) a térfogattömeg, (c) a hangsebesség adott közegben. A képlet lényege, hogy z=ρ1*c1 akusztikai keménységű közegbe ρ2*c2 akusztikai keménységű (d) vastagságú lemez merül. Ekkor a lemezre merőlegesen beeső hangrezgések visszaverődési foka: (R). Ebből az átvezetési fok: S=1-R. Kvarcüveg esetében ρ2=2600Kg/m3, c2=5370m/s, λ=0,0048m, d=0,0001m. Víz esetében ρ1=1000Kg/m3, c1=1483m/s, λ=0,001327m. A hangenergia változását minden intenzitásszint mellett kifejeztük.
3.2. Nem állandó hőmérsékletű ultrahang sugárzófejjel végzett vizsgálatok
A kísérletekhez, a folyadékáramoltatásos rendszernél ismertetett jelgenerátort (1) és nagyfrekvenciás erősítőt (2) alkalmaztunk, a 8. ábrának megfelelő elrendezésben. Az alkalmazott ultrahang sugárzófej eltért a folyadékáramoltatásos rendszernél ismertetettől. Az aktív elem szintén bárium-titanát, viszont átmérője 20mm volt, mely öntött alumínium foglalatban (3) helyezkedett el. A sugárzóelem alumínium foglalatára egy 40mm átmérőjű műanyag hengert (4) erősítettünk, melybe a kezelt szuszpenzió, mint hangtér került elhelyezésre.

A nem állandó hőmérséklet azt jelenti, hogy az ultrahang sugárzófej egyetlen elemére sem alkalmaztunk állandó hőmérsékletet (hűtést), így a kezelés folyamán a hangtér, vagyis a kezelt szuszpenzió hőmérséklete nagyobb mértékben emelkedhetett, az intenzíven el nem szállított veszteséghő miatt, mint az állandó vízköpeny hőmérsékletű, vagy a folyadékáramoltatásos berendezés hangterének hőmérséklete. A berendezést 20°C-os léghőmérsékletű helységben üzemeltettük és a kezelés megindításától számított 10 percen belül 39-43°C-os szuszpenzió hőmérséklet alakult ki, amely több órás kezelés alatt sem melegedett tovább. E hőmérséklettartomány mellett a hőpusztulás még nem jellemző. A kezelt szuszpenzió mennyisége minden esetben 50ml volt. Az alkalmazott sejtszuszpenzió koncentrációkat hozzávetőleg 0,4-2*107/ml-re állítottuk be.
A 40mm átmérőjű hengerben az 50ml szuszpenzió 41mm magasságot ér el, ezért mivel vizes szuszpenzióban a hang sebessége c=1483m/s 20ºC mellett és 1110kHz frekvenciánál ez 1,33mm hullámhosszt ad, így 41mm 30λ (hullámhossz) a távolságnak felel meg, viszont a reflexió miatt az összes hangenergia a kezelőedényben marad. A hullámhossz több mint százszorosa az élesztőgomba átmérőjének.
A 3. ábrán látható, hogy az ultrahangsugár a közegek akusztikai keménységétől függő mértékű szögekben széttartó, divergens, tehát az ultrahangtér alsó régiója, a sugárzófej sugárirányában gyengébben szórt lehet ultrahanggal. A kavitáció és az akusztikai áramlásnál intenzív áramlások turbulenciák alakulnak mely keverő hatására a hangtér minden pontja, állandóan keveredik, így elméletileg minden részecske a hangtér minden pontján ugyanakkora időintervallumig tartózkodik. Az effektív kezelési idő meghatározását azért nem végeztük el, mert a divergencia a pillanatnyi véletlenszerű szemcsekoncentrációtól, anyagi minőségtől is függ, amit nem ismertünk, illetve a holttér akusztikai nyomás amplitúdója függ még a buborékokon és szemcséken lévő hangszóródástól, ami szintén ismeretlen tényező.
A kísérletekhez 6,5 és 8,5W kicsatolt ultrahang teljesítményeket alkalmaztunk, melyeket a 3,14cm2 sugárzási felület ismeretében felületegységre eső teljesítményre átszámítva, 8,5W esetén 2,7W/cm2, 6,5W esetén 2,07W/cm2 volt a felületegységre eső teljesítmény.
Minden mintához 5csepp 1%-os töménységű metilénkék oldatot adtunk, amivel a sejtek vitalitását vizsgáltuk, e mennyiség a kontrollvizsgálatok alapján nem befolyásolta a mikroorganizmusok vitalitását, a kezelési időszakon belül. A kezelés folyamán az elsötétedett sejtek a pusztult állapotot, a világos sejtek az élő mikroorganizmusokat mutatták. A kezelés beindításától adott időközönként vett 15μl mennyiségű mintákat mikroszkóp tárgylemezre helyeztük, majd azt fedőlemezzel lefedve, immerziós objektív alatt vizsgálva, mintánként legalább 15 látóteret leszámolva és átlagolva kaptuk meg a túlélési eredményeket.
A kapott eredmények alapján minden kiinduló koncentrációnál és minden teljesítményszinten meghatároztuk a tizedelési időket, amiket grafikonos és táblázatos formában dolgoztunk fel.
3.3. Hőhatás meghatározásának eszközei ultrahangtérben
A kísérletek végrehajtásához speciális ultrahang berendezés rendszert terveztünk és kiviteleztünk. Célunk egy olyan műszerrendszer megalkotása volt, mely segítségével kiterjedten, reprodukálható módon vizsgálhatók a nagyfrekvenciás aktív ultrahang fizikai és biológiai hatásai. A tervezés kiterjedt a jelgenerátorra, az ultrahang erősítőre, az ultrahang sugárzófejre, illetve kezelő edényrendszerre, továbbá a teljes kísérleti felépítményrendszerekre. Figyelembe vettük azt, hogy a kísérletek átfolyó és töltő-ürítő rendszerben is végrehajthatóak legyenek.
Az ultrahang hőhatásának vizsgálatához felhasznált anyagok és eszközök három csoportra bonthatóak: „A” az alkalmazott kezelő berendezések, „B” a vizsgált minta és „C” az elemző rendszerek tekintetében. A 9. ábra mutatja az ultrahang hőhatásának vizsgálatára alkalmazott kísérleti rendszert.
Az ultrahang jelgenerátor szinusz jelformát állít elő, 1kHz–16MHz frekvencia tartományban, mely 1kHz frekvencia tartományonként manuális frekvenciaállítási lehetőséget biztosít, a kettes számrendszernek megfelelő kapcsolós léptetéssel. A frekvencia beállítást a fényképen látható berendezés bal felső részén lévő kapcsolósorral végezhetjük el. A készülék az aktuálisan alkalmazott frekvencia értéket egy monitor egységen jelzi ki, mely a készülék középső részén látható. A jelgenerátor kapcsolási rajzát, illetve elektronikai karakterisztikáját az I. melléklet 1-2. ábrája tartalmazza.
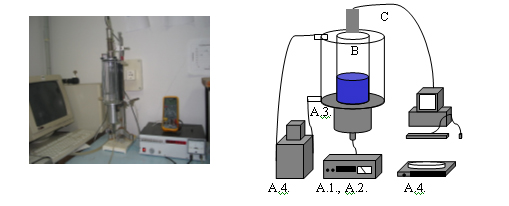
(A.1., A.2. ultrahang jelgenerátor és erősítő, A.3. ultrahang rezonátor, A.4. vízfürdő, A.4. analitikai mérleg, B. hangtér, C.. hőmérő egység)
Az ultrahang erősítő 100kHz–2MHz frekvenciatartományban jó közelítéssel lineáris, erősítési szintet ad. A piezokerámia, illetve a kezelőedény rendszer ellenállása 50Ω. Emellett az impedancia érték mellett az ultrahang erősítő 0-40W erősítést tesz lehetővé. Az erősítés mértékét egyenfeszültségben adja meg, melyet kalibrációs görbe segítségével és a sugárzási felület ismeretében W/cm2 értékre tudunk vonatkoztatni. A kivezetett feszültségjelet multiméterrel dolgoztuk fel, melyet RS232 csatlakozón keresztül számítógéppel csatlakoztattunk. A multiméter adatait a valós idő függvényében számítógép kezelte, így on-line regisztrációs és adatrögzítési, valamint vizualizációs lehetőségünk volt, és az adatokat egyetemi licencű Excel-ben dolgozhattuk fel.
A rezonátor, illetve a kezelőedény felépítését a 10. ábra mutatja be sematikusan. A vizsgálatainkban folyamatos hullám (CW) módot alkalmaztunk, legfőbbképpen longitudinális hullámformát előállítva. A kezelőedény kialakítása alkalmas az álló és a haladó sík hullámok kialakítására is. A kezelőedény és a ultrahang sugárzófej eredeti tervrajzai a I. melléklet 3.-4. ábráján láthatók.
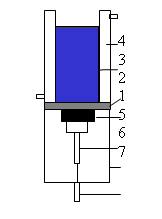
(1. piezoelektromos kerámia, 2. elektro-akusztikai csatolás, 3. hangtér, 4. állandó hőmérsékleten tartott kettős falú edény, 5. elektromos csatolás, 6. készülék ház, 7. elektromos csatlakozó.)
A rezonátor fő aktív eleme a PZT-4 ólom cirkonát kerámia, melynek rezonancia frekvenciája 1,1MHz frekvenciára tervezett és a sugárzó rendszerrel egybeépítve bemérése alapján 1180, 1097 és 989kHz frekvenciákon vannak rezonancia értékei. A piezoelektromos kerámia síkfelületű, átmérője 22mm. A kerámia, illetve a teljes kezelő berendezés Smith-diagramjai, a viszonylagos akusztikai és elektronikai impedancia, a rezonancia-frekvenciamérési értékekkel az II. melléklet 1. 2. 3. és 4. ábráján láthatóak. Az ultrahang sugárzófejen található elektro-akusztikai csatolás egy elektronikai, akusztikai és áramlástani szempontok szerint tervezett lapka, melynek anyaga speciális alumínium ötvözet és a vastagsága az anyagban mért hangvezetési sebességből kapott fél hullámhossz. Ezáltal a lapkán a hangenergia visszaverődése a longitudinális hullámokra vonatkoztatva elméletileg nulla, így a maximális hangáteresztés biztosított. Ebben az esetben mindössze a lapka anyagi minőségéből adódó abszorpció érvényesül, ami a speciális anyagából adódóan az átengedett hangsugárzás értékéhez képest szintén elenyésző. Így a lapkán keletkező veszteséghő is minimális.
A hangtér, vagyis a kezelt anyag foglalatát kettős falú, 30mm belső és 80mm külső átmérőjű, 200mm magas, hengeres kialakítású állandó hőmérsékleten tartott kettős falú üvegedényből alakítottuk ki. A két üvegfal közötti vízköpenyt gumicsöveken keresztül csatlakoztattuk össze a LaudaE100 típusú hűtő-fűtő vízfürdővel, amely a hangtér állandó hőmérsékleten tartását biztosította. A kettős falú üvegköpenyt felülről csavarokkal biztosított nyomóerő nyomja a sugárzófej akusztikai csatolására, egy gumitömítés ellenében. A számításaink szerint az [1]. Nkör=D2*f/4*c képlet alapján, az alkalmazott szuszpenzió mennyiség a hangtér near field tartományába esik. Ennek oka, hogy mivel a rezgő piezoelem átmérője D=0,022m, a frekvencia f=1117000Hz, a hullám terjedési sebessége c=1483m/s, ebből adódóan (0,0222*1117000)/(4*1483)=0,091m, vagyis 9,1cm távolságig (magasságig) terjed az ultrahang sugárzófejtől a near field tartomány az adott sugárzási körülmények között. Az alkalmazott 25ml kezelt szuszpenzió pedig 3,53cm, vagyis 26,6λ magasságú. A zárt vízköpeny miatt nem fordulhat elő keveredés az állandó hőmérsékletet biztosító víz és a kezelt anyag között.
A piezoelektromos kerámia alatt található speciális kialakítású Gruetzmacher-féle légréssel ellátott gyűrűszerű elektromos csatolás a készülékházba épített elektromos csatlakozó aljzaton keresztül csatlakozik az erősítőhöz. A légréteg azt biztosítja, hogy a váltakozó feszültség és a negatív piezoelektromos hatás által kialakított mechanikai rezgések csaknem 100%-ban az akusztikailag keményebb alumíniumlapka felé terjedjenek a kerámiából, mivel a légréteg a piezoelektromos kerámiához kvázi tökéletes reflektorként csatolódik. Így a veszteségek minimalizálhatóak, továbbá biztosítható a rezgés egy irányba való továbbítása. Könnyen belátható, hogy ezzel a tervezési módszerrel a vizsgálatok végrehajtásához rögtön 50%-os mechanikai energia-nyereségünk adódik.
A nem rideg reflektor maga a folyadék felett található légréteg, amely mint tökéletes reflektor, a sugárzás 100%-át visszaveri a folyadékba, így például állóhullám kialakításában elsődleges szerepe van. A komplett rezonátornak, a vizsgálati folyadékmennyiséggel feltöltött állapotban, 1117kHz frekvencián van rezonancia maximuma.
A tömeg mérésére Precisa 505M-2020C DR SCS, ±0,001g pontosságú analitikai mérleget alkalmaztunk.
Termoelemet és infrahőmérőt alkalmaztunk hőmérsékletmérésre (11., 12. ábra). A termoelemet multiméterhez csatlakoztattuk és számítógéppel regisztráltuk az adatokat az idő függvényében. Mérési lépcsője 1ºC, méréstartománya 0-350ºC. A termoelemet méréskor a folyadékba helyeztük, mégpedig minden mérés esetében, a 9. ábrának megfelelően, a hangtér hosszanti középtengelyének felső negyedébe került.
Az „Almemo” gyártmányú infrahőmérő ±0,1ºC mérési pontosságú, 0-300ºC méréstartományú berendezés. Elhelyezése a kezelt minta felett minden mérés esetében 20cm-re történt, méghozzá a minta mértani középtengelyében. Ennek az elhelyezésnek az oka, hogy a hőmérő mérőzónája egy adott nyílásszöggel rendelkezik, tehát a mérendő zónától való távolság növekedésével egyre nagyobb zóna hőmérsékletét méri, így a pontatlan elhelyezésből mérési pontatlanságok eredhetnének.

Az infrahőmérőt adatgyűjtő alegységen keresztül számítógéppel csatlakoztattuk, amely az adatokat az idő függvényében regisztrálta, illetve adatfájl formátumban eltárolta. Az alkalmazott szoftvert mi írtuk C++ (S/N: CPP1145WW10180) programnyelven. Alkalmaztuk még a LabView (S/N: J10X45461) szoftvert is az adatgyűjtéshez. A végső adatfeldolgozás egyetemi licencű Excel programmal történt.
Vizuális megfigyelési módszert is alkalmaztunk a kavitáció és állóhullám idő függvényébeni nyomon követésére, majd a vizuális tapasztalatokat összevetettük a tapasztalt hőmérsékletváltozási jelenségekkel.
3.3.1. Az ultrahang hőhatásának vizsgálati módszere
Önállóan vizsgált, illetve
szuszpendáló anyagként friss csapvizet alkalmaztunk. A kísérletek alatt a kettős
falú üvegedényben lévő vízköpenyt mindig adott hőmérsékleteken tartottuk.
Szuszpendált anyagként a „Budafoki Élesztőgyár” által előállított, kereskedelmi
forgalomban kapható préselt élesztőt, illetve dolomitport használtunk. A
dolomitporban lévő szemcsék 90%-a d=25mm,
50%-a d=10mm
és 10%-a d=3mm
alatt van, és az átlagos szemcsemérete:
![]() =kb.12
mm,
mely térfogattömege 2,85g/cm3. A szemcseméret-eloszlás
meghatározására irányuló három párhuzamos vizsgálatot MALVERN Instruments M7
típusú készülékkel végeztettük. A dolomit szemcsék és az élesztő sejtátmérője
így összeegyeztethető a fizikai vizsgálatokhoz.
=kb.12
mm,
mely térfogattömege 2,85g/cm3. A szemcseméret-eloszlás
meghatározására irányuló három párhuzamos vizsgálatot MALVERN Instruments M7
típusú készülékkel végeztettük. A dolomit szemcsék és az élesztő sejtátmérője
így összeegyeztethető a fizikai vizsgálatokhoz.
Analitikai mérlegen a szuszpendálandó anyagból, a vizsgálathoz szükséges koncentrációnak megfelelő mennyiséget mértünk be ±0,001g pontossággal. Ezután a lemért szuszpendálandó anyagot hozzáadtuk a szuszpendáló szerként használt megfelelő mennyiségű vízhez. A lombik tartalmát ezután 1-2percig mágneses keverővel homogenizáltuk. A homogén, adott koncentrációjú szuszpenzióból 25ml mennyiséget mértünk be a kezelő berendezésbe. A kezelő berendezést, vagyis az ultrahang sugárzófejet és a hangteret a megfelelő hőmérsékletű vízköpeny segítségével folyamatosan, az aktuálisan elvárt hőmérsékleten tartottuk. Így a 25ml szuszpenzió beöntése után még 3-5perc hő beállási időt alkalmaztunk. A szuszpenzió kezelő berendezésbe való bemérése után az alkalmazott infra, vagy kontakthőmérési módszernek megfelelően, az alkalmazott anyagok és eszközök fejezetben leírt módon helyeztük el a mérőberendezést, illetve a járulékos berendezéseket, a számítógépeket, adatgyűjtő berendezéseket és az adatgyűjtő szoftvereket üzemeltük be.
A hő beállási idő elteltével az 1117kHz frekvenciájú, 9W/cm2 teljesítményű jelet kezelőedényre csatoltuk. Ettől a pillanattól kezdve a kezelőedényben mind vizuálisan, mind műszeresen nyomon kísértük és dokumentáltuk az akusztikai jelenségeket, illetve a hőmérsékletváltozást. A hőmérsékletmérés az előre eltervezett időszakon keresztül folyt, majd az erősítést a hőmérés után megszüntettük és elmostuk a kezelőedényt.
Kísérleteink során az élesztő és a dolomit szuszpenziókat 10 és 20g/l koncentrációk és 0-60ºC hőmérsékletű vízköpeny mellett vizsgáltuk. Három kísérletsorozatot végeztünk, melyből az első, a 10g/l koncentrációjú élesztő szuszpenzió, 0-60ºC tartományban, 10ºC vízköpeny hőmérsékleti lépcső melletti hőmérsékletváltozási analízisét jelentette, a második sorozatban ugyanezt vizsgáltuk 20g/l élesztőgomba koncentráció mellett. A harmadikban pedig dolomit szuszpenziókat vizsgáltunk, illetve élesztő-dolomit szuszpenziókat a fenti koncentrációkkal.
A vizsgálatok során minden hőmérsékleti lépcső mellett külön felvettük a víz és külön az adott koncentrációjú szuszpenzió hőmérsékletváltozását. Ennek segítségével, az eredményeket táblázatos és grafikonos formában dolgoztuk fel. A „nyers” hőmérsékletmérési értékeket mutató diagramokat „szono-termogram”-nak, az adott állandó hőmérséklet mellett, a tiszta víz ultrahangos kezelés alatti hőmérséklet értékeiből kivont, minden adott kezelési időpillanatra vonatkozó szuszpenzió hőmérsékleti értékeit pedig „differenciál szono-termogram”-nak neveztük el. A differenciál szono-termogram megmutathatja, hogy mely kezelési tartományokban mekkora a különbség a víz és a szuszpenzió hőmérséklete között adott kezelési időszak elteltével. Továbbá a differenciál szono-termogram megmutathatja azt, hogy milyen akusztikai jelenségek játszódtak le az ultrahangos kezelés alatt az anyagban. A differenciál szono-termogramokat kísérletsorozatokban, illetve az egyes kísérletsorozatok között hasonlítottuk össze.
3.4. Akusztikai jelenségek kialakulásának vizsgálata
3.4.1. Kezelő berendezések
Az alkalmazott ultrahangrendszer jelgenerátora és erősítője megegyezik a 3.3. fejezetben ismertetettel. A kísérletekhez szinusz jelformát használtunk, 1,117MHz frekvencián, 0-12W/cm2 teljesítménnyel.
3.4.2. Vizsgált szuszpenzió
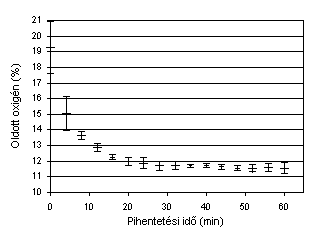
Szuszpendáló szerként ½-1óra időintervallumon keresztül pihentetett csapvizet használtunk, melyet 20ºC hőmérsékletű, nem rázatott vízfürdőben pihentettünk. A víz oldott oxigén tartalmának, mint potenciális kavitációs magnak a változását, New Brunswick Scientific BIOFLOW III fermentorhoz tartozó 12mm átmérőjű „Ingold” típusú oldott oxigénmérővel követtük, melynek az idő függvényében a fent ismertetett körülmények közötti eredménye a 13. ábrán látható. Megfigyelhető, hogy a nagyon eltérő kiinduló oxigén tartalmú vízminták között, az alkalmazott pihentetési időintervallum után, ±0,5%-nál kisebb oldott oxigén tartalom eltérés mutatkozott, ami a kísérletek reprodukálhatóságának egyik alapfeltétele volt. A pihentetett vízminták oldott oxigéntartalma 20ºC hőmérsékleten 11-12% közé csökkent és onnan tovább már nem változott. A mért százalékos értékeket úgy kell értelmezni, hogy az oxigénmérő 100%-os analitikai tisztaságú oxigénnel majd hidrogénnel és végül 0%-os mérő nélküli kalibrációja után a 100% telítettséghez képesti folyadékbeli oxigéntelítettség százalékos értékéről van szó. E méréssel a szuszpendáló szer alkalmazhatóságát bizonyítjuk. Szuszpendált anyagként liofilizált és préselt Saccharomyces cerevisiae pékélesztőgombát, illetve az élesztővel megegyező átlagos átmérőjű dolomitszemcséket alkalmaztunk, amelyeket a 3.3. fejezetben is alkalmaztunk.
3.4.3. Kavitációs zaj vizsgálata
Veit (1977) szerint a kavitáció akusztikailag zajként jelentkezik, ami mikrofonnal felvehető és elemezhető. A kavitációs zaj vizsgálati módszerünk ezen alapult. A műszeres kavitációs zaj elemző rendszer részei a mikrofon, az erősítő és az oszcilloszkóp voltak. A kondenzátormikrofont az ultrahang sugárzófej külső részén a beeső ultrahang sugárra merőlegesen rögzítettük, a 14. ábra szerint. Az elemzési eljárás célja, az objektivitás, attól függetlenül, hogy a kavitáció zaja jól hallható.
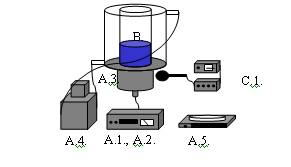
14. Ábra: Akusztikai jelenség vizsgáló rendszer
(A.1., A.2. ultrahang frekvencia generátor és erősítő, A.3. ultrahang rezonátor, A.4. vízfürdő, A.5. analitikai mérleg, B. kísérleti minta, hangtér, C.1. analóg kavitációs zajelemző egység).
Az oszcilloszkóp képernyőjén kísérhettük figyelemmel a jelintenzitást és hullámformát. Ha a vizsgálat előtt kalibrációt végeztünk és kijelöltük a monitoron a kavitációmentes háttérzaj és a kavitációs zaj jelszintjét, ezzel a kialakuló, vagy megszűnő kavitációt objektíven követhettük.
Az állóhullámot és az akusztikai áramlást vizuálisan vizsgáltuk a hangtérben, mivel többek között Saad és Williams (1985) is rámutattak, hogy ultrahang által kiváltott kavitáció miatt folyadékban vizuálisan megfigyelhető akusztikai áramlások alakulnak ki. Wathmough et al. (1990) szintén akusztikai áramlás miatti folyadékkeveredést tapasztaltak a hangtérben. Church és Miller (1983) kísérletében pedig azt tapasztalta, hogy az állóhullám eredményeként a sejtek és a buborékok egymástól elkülönülten rétegződtek. Ezáltal a kavitáció, az akusztikai áramlás és az állóhullám vizuálisan megfigyelhető jelenségek.
3.4.4. Kavitációs határkoncentráció meghatározása
3.4.4.1. Kavitációs határkoncentráció meghatározásának alapmódszere
A 25ml, ½-1órán keresztül pihentetett csapvizet töltöttünk be a kezelőedénybe. A hangteret folyamatosan 20ºC hőmérsékleten tartottuk, állandó hőmérsékletű vízköpeny segítségével. Analitikai mérlegen bemérő kanálra, a mintából 0,5-1g mennyiséget mértünk be ±0,001g pontossággal. Bekapcsoltuk a hangtér jelenségeit elemző berendezéseket. Sugárzófejre kapcsoltuk az ultrahangot, a tiszta vízben megindult a kavitáció, vizsgálhatóvá vált a kavitációs zaj. A bemérő kanál segítségével elkezdtük beadagolni a szuszpendálandó szemcséket. A beadagolás addig tartott, amíg a műszeresen elemzett kavitációs zaj meg nem szűnt. Ez a kavitációs határkoncentráció. A kavitációs határkoncentráció meghatározásához, a fogyott anyagmennyiséget analitikai mérlegen ±0,001g pontossággal visszamértük. A kísérleteket minden mintánál, minden teljesítményszinten négyszer megismételtük.
3.4.4.2. Kiegészítő módszer kavitációs határkoncentráció meghatározására
Alkalmazásának célja, hogy az alapmódszer kavitációs küszöb eredményeit tovább pontosítsuk közelítő módszer segítségével. Az alapmódszer segítségével kapott kavitációs határkoncentráció alatti és feletti tömegbeméréssel megközelítettük a kavitációs határkoncentrációt. Ha három, egymástól maximum 2mg-ban különböző szuszpendált minta közül a középső minta esetében, az ultrahang bekapcsolása után 2 másodpercen belül beindult a kavitáció, az alatta lévő tömegnél azonnal, a felette lévőnél jóval később, akkor ismertnek tekintettük a kavitációs határkoncentrációt a középső és alsó mintatömeg átlagára vonatkozóan.
3.4.5. Kavitáció kialakulási időintervallum vizsgálata
A hangtérbe 25ml 20ºC-os pihentetett csapvizet töltöttünk. A különböző típusú szemcsék esetében, a kavitáció kialakulási időintervallumot, minden egyes kezelési teljesítmény szinten a kiegészítő módszer segítségével mért kavitációs határkoncentráció értékek 1,5-szeres mennyiségének hangtérbe adagolásával vizsgáltuk. E mennyiség alkalmazásánál azt követtük, hogy mivel új megfigyelés és módszer kidolgozása történt, ne távolodjunk el túlzottan az ismert kavitációs határkoncentrációtól, mivel ekkor nagy lenne annak a kockázata, hogy nem tudnánk, mi történik a két távoli koncentráció között az akusztikai jelenségek alakulásával. A szemcséket tehát az aktuális kiegészítő vizsgálatból származó kavitációs határkoncentrációra mért értéknek 1,5-szeres mennyiségében, a hangtérben előszuszpendáltattuk, majd a keverő hangtérből való eltávolítása után az aktuális kavitációs határkoncentrációnál alkalmazott teljesítménnyel megegyező teljesítményt kapcsoltuk a sugárzófejre. Az ultrahang bekapcsolásától a kavitáció kialakulási időpillanatig eltelt időintervallum a kavitáció kialakulási időintervallum. A vizsgálatokat négy ismétléssel végeztük.
3.4.6. Kísérleti terv
1,117MHz frekvencián meghatároztuk a különböző szuszpendált szemcsékre vonatkozó „kavitációs határkoncentráció” értékeket, g/25ml és ebből g/l koncentrációra, 3, 6, 9 és 12W/cm2 teljesítmény mellett, 20°C hőmérsékleten, az alap majd a kiegészítő módszer segítségével. A kiegészítő vizsgálatból kapott határkoncentráció 1,5-szeres mennyiségének felhasználásával a „kavitáció kialakulási időintervallum” vizsgálatát végeztük.
3.5. Pusztulási dinamika meghatározása az akusztikai jelenségek függvényében
3.5.1. Kezelő berendezések
Az ultrahangkezelést ugyanazzal a berendezéssel végeztük, mint amit a 3.3. és 3.4. fejezetben alkalmaztunk (Lőrincz, 2004a).
3.5.2. Szuszpenzió
Szuszpendáló szerként ½-1órán keresztül pihentetett, 20ºC hőmérsékletű csapvizet használtunk. Szuszpendált anyagként háztartási liofilizált Saccharomyces cerevisiae pékélesztőgombát alkalmaztunk.
3.5.3. Az akusztikai jelenségek és a sejtbiológiai hatások vizsgálata
A vizsgálatok alatt a kavitációs zajt, a 3.4.3. fejezetben ismertetett módon, kondenzátormikrofon, erősítő és oszcilloszkóp segítségével vizsgáltuk. A vizuális módon a megfigyelhető akusztikai jelenségeket, az állóhullámot, az akusztikai áramlást és a folyadéksugár kialakulását a kezelési idő függvényében folyamatosan nyomon kísértük.
Az élesztő kezelés alatti életképesség változását metilénkék vitálisfestéssel vizsgáltuk, a képeket biológiai mikroszkópra szerelt CCD kamerán keresztül számítógéppel rögzítettük.
3.5.4. Kísérleti terv
A biológiai hatás és akusztikai jelenség vizsgálatokhoz a liofilizált élesztőre előzetesen a 3.4. fejezet szerint 1,117MHz frekvencián, 9W/cm2 teljesítmény mellett, 20°C hőmérsékleten, kiegészítő módszer segítségével meghatározott, kavitációs határkoncentráció eredményeit használtuk fel.
A kiegészítő vizsgálatból kapott kavitációs határkoncentráció többszörös (1; 1,5; 1,7; 2,2; 3.) mennyiségeinek felhasználásával került sor az „állóhullám kialakulási időpillanat”, a „kavitáció kialakulási időpillanat”, és a biológiai hatások vizsgálatára, szimultán módon.
3.5.5. Vitális sejtszám és a hangtér akusztikai jelenségeinek szimultán vizsgálata
Az ultrahang sejtroncsoló hatásai a szakirodalom szerint azonnal jelentkeznek a sejteken. A hangtérbe, a kísérleti tervben meghatározott koncentráció elérése érdekében, 25ml mennyiségű szuszpendáló szerbe megfelelő mennyiségű biológiai anyagot szuszpendáltunk bekeveréssel, majd a keverőt eltávolítottuk onnan. Ezután három csepp 1% töménységű metilénkék oldatot cseppentettünk a hangtérbe. Az ultrahang bekapcsolásának pillanatában egy mintázó órával mérni kezdtük; majd 15 másodpercenként 0,05ml mennyiségű mintákat vettünk a kezelt szuszpenzióból, ebből vizsgáltuk a relatív élősejtszámot a látóterenkénti világos és festődött sejtek számarányának meghatározásával, minden minta esetében a megfelelő konfidencia intervallum elérése érdekében legalább mintánkénti 15 látótér leszámolásával és átlagolásával. A mintavételeket a hangtér akusztikai hullámjelenségeinek állandósult állapotáig végeztük.
Stopperórával, mértük a kísérletek beindításától az állóhullám kialakulásáig, illetve a kavitáció kialakulásáig, vagyis a műszeresen vizsgálható kavitációs hang megjelenéséig eltelt időt.
Deák (1997) szerint meghatároztuk a „D” tizedelési időintervallum és a „k” fajlagos pusztulási sebesség értékeket, az egyes kísérletek különböző akusztikai jelenségszakaszaira, majd ábrázoltuk a túlélési görbéket.
3.6. Sejtanalitikai eljárások
A sejtanalitikai eljárásaink analóg és digitális elvet követnek. A vizsgálatok alapja, a teljesítmény, a frekvencia, a kísérleti felépítmény, az alkalmazott sejtkoncentráció megegyezik 3.5. fejezetben leírtakkal.
A kezelt szuszpenzióból folyamatosan mintát vettünk, majd a mintát detektor egységbe vittük és a detektorból érkező jelet műszeresen analizáltuk, analóg, vagy digitális módon.
3.6.1. Analóg sejtanalízis
Az analóg sejtanalitikai rendszer, a 3.5. fejezetnél is alkalmazott kezelőedényben lévő szuszpenzióból áll, amiből egy kivezető folyadékágon keresztül perisztaltikus szivattyú segítségével állandó áramlási sebesség mellett folyadékot szivattyúztunk ki, illetve az analízis után azt egy másik ágon folyamatosan visszavezettük (15. ábra).
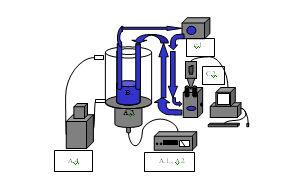
15. Ábra: Sejtanalitikai rendszer sematikus ábrája
(A.1., A.2. jelgenerátor és ultrahang erősítő, A.3. ultrahang sugárzófej, A.4. vízfürdő, B. hangtér, vagy szuszpenzió, C.1. perisztaltikus szivattyú a folyadékáramoltatásos rendszerrel, C.2. optikai átfolyó küvettával ellátott biológiai mikroszkópra szerelt CCD kamera a jelfeldolgozó számítógéppel.)
A kivezetett folyadékot optikai átfolyóküvettába vezettük, amely 10mm átmérőjű, korong alakú, üreges kvarc küvetta, mely kialakítását tekintve megegyezik a 7. ábrán bemutatott ultrahangos kezelő küvettával, melyben a kezelt szuszpenzió áramlik (Lőrincz, 2004b). Detektorként biológiai mikroszkópot alkalmaztunk, melyre CCD kamerát szereltünk (16. Ábra).

16. Ábra: Detektorként használt biológiai mikroszkóp
A küvettában áramló sejtek 1000-szeresre nagyított képe jutott el a kamerába. A folyadékáramoltatás, és az egyszerre sok sejtet befogadó látótér jó lehetőséget biztosít egy számláló célműszernek ahhoz, hogy az élő sejtszám változásáról állandó objektív adatokat biztosítson. A kamerából a jel két irányban jutott tovább. Az egyik a számítógép, a másik az álszín kódoló. Az archiváló számítógép egyetemi licencű Windows operációs rendszerrel, és videokártyával rendelkezik.
Az álszín kódoló mesterséges látásra fejlesztett rendszer, melyet a NASA az EUREKA programban égitestek és egyéb mesterséges objektumok felkutatására alkalmazott. Az álszín kódoló a teljes ultrahangrendszert mutató 17. ábrán az RGB bontó televízió tetején, illetve az általa közvetített kép a II. melléklet 5. ábráján látható. A műszer a fény visszaverődése, így a szürkeségi fokok alapján tesz különbséget az objektumok között. A túlélő sejtszám változása vitális festés által, a pusztuló sejtek folyamatos kék elszíneződése, elszürkülése miatt követhetővé válik, melyből viszonyszámok adódnak. Ezek a viszonyszámok egy kalibráló sor felvétele után alkalmasak arra, hogy a mikroorganizmusok térfogat egységenkénti túlélő, vagy pusztulási számát pontosan megadják. A viszonyszámokat elektronikai elven egyenfeszültség jellé alakítottuk át és így a jelfeldolgozás a valós időben műszeresen is megvalósulhatott. Az álszín kódolótól érkező egyenfeszültség jelet az idő függvényében analóg plotter, illetve adatgyűjtő multiméteren keresztül számítógéppel értékeltük.

17. Ábra: Sejtanalitikai rendszer az álszín kódolóval
(A. Analóg kavitáció detektor rendszer, B. Digitális sejtanalitikai rendszer, C. Analóg sejtanalitikai rendszer, D. Ultrahang rendszer, E. Hőhatás vizsgáló rendszer)
3.6.2. Digitális sejtanalízis
A digitális sejtanalízis elve, hogy a detektorból érkező képet adott időközönként CCD kamerával fájl formában lefényképezve (archiválva), a fényképeket egy képanalizáló szoftver segítségével értékelve kaptuk meg az eredményt. A képek feldolgozásához az „IDRISI” (ID: 63473) professzionális térinformatikai szoftvert alkalmaztuk, melynek segítségével lehetőségünk volt a bevitt, maximum 8bit színmélységű, bitmap (BMP) fájlformátumú képet szürkeségi fokokra bontani. Így a túlélés hisztogram-szerűen dolgozható fel, és kalibráció alapján lehetőség van a pusztulás időbeli mértékének meghatározására, hisztogram segítségével.
3.7. Pseudomonas aeruginosa HNCMB170001 feltételesen kórokozó baktériumtörzs ultrahangkezelésének anyaga és módszere
Elsőként a liofilizált baktériumtörzset felélesztettük, majd beállítottuk a kívánt sejtkoncentrációkat, ezután a kiinduló sejtkoncentrációval kontrollvizsgálatot végeztünk, illetve a beállított, kiinduló sejtkoncentrációjú mintákon elvégeztük az ultrahangos kezeléseket és ezután a kezelt minták kicsíráztatását és az eredményeket a szabványos módszerrel kiértékeltük.
A kísérletek elvégzése során arra törekedtünk, hogy a 3.5. fejezetben leírt kísérleti körülményektől semmiben ne térjünk el. Így hasonló abszolút sejtkoncentrációkat állítottunk be, hasonló frekvenciát, hűtőhőmérsékletet, kezelt szuszpenzió mennyiséget alkalmaztunk, hasonlóképpen vizsgáltuk a kísérletek folyamán kialakult akusztikai jelenségeket. A túlélő sejtszámot, vagyis a mikrobiológiai vizsgálatokat a Nyugat-Magyarországi Egyetem, Élelmiszertudományi Intézetének DAR akreditációval rendelkező patogén laboratóriumában végeztük, mikrobiológus irányítása és felügyelete mellett.
3.7.1. A referenciatörzs felélesztése
Referenciatörzsként Rt14 Pseudomonas aeruginosa HNCMB170001 feltételesen kórokozó baktériumtörzset alkalmaztunk, amit az OKI-tól szereztünk be liofilizált formátumban. A liofilizált törzset GSP táptalajon revitalizáltuk
3.7.2. Sejtkoncentráció beállítása
A sejtkoncentrációt „DENSIMAT” műszerrel állítottuk be, amely minták élősejtszámát azután összcsíraszám meghatározással kontroláltuk. A koncentráció eredményt McFarland fokban kaptuk, amit kalibráló skálán keresztül baktérium koncentrációra váltottunk át. A hígításokat minden esetben 0,85% koncentrációjú nátrium-klorid (NaCl) tartalmú peptonvízzel végeztük, a L 03.00-1 szabvány szerint.
3.7.3. Pseudomonas aeruginosa HNCMB170001 baktériumtörzs élősejtszám meghatározása, összcsíraszám meghatározással
Az élősejtszám meghatározását az ÉTI-ML-SOP-VU-FM-01-A/2 ref.: L06.00-18 szabvány alapján végeztük, melynek címe a „Vizsgálati utasítás az aerob csíraszám meghatározásához 30°C-on húsból és húskészítményekből”.
A vizsgálat elve, hogy a vizsgálandó mintából decimális hígítási sort kell készíteni, majd annak tagjaiból 1-1ml mennyiséget Petri-csészékbe kell pipettázni, majd Plate-Count agarral egyenletesen elkeverni. A lemezeket 72 órán át 30°C-on kell inkubálni aerob körülmények között, majd a fejlődött telepeket megszámolni és azt a minta ml-ére vonatkoztatni. Az alkalmazott táptalaj, Plate-Count Agar elkészítését SOP-03-1/3 szerint kell végezni, jelesül az ÉTI-ML-SOP-03 szabvány szerint. Az inkubálás után telepszámlálást végeztünk és azokat a lemezeket vettük figyelembe, ahol a telepek száma 20-300 közötti volt. A csíraszám számítását az értékelhető lemezek telepszámának súlyozott átlagaként kell számolni a következő [16]. képlet alapján:
C=((ΣC)/(n1+0,1n2))*d, ahol [16].
C a telepszám súlyozott középértéke, ΣC a számításba bevont valamennyi lemez telepeinek összege, n1 a legalacsonyabb kiértékelhető hígítási fokhoz tartozó lemezek száma, n2 a következő kiértékelhető hígítási fokhoz tartozó lemezek száma, d a legkisebb kiértékelt hígítási szint hígítási faktora.
3.7.4. Kontrollvizsgálat
Célja a kiinduló sejtkoncentráció ismeretében a kiinduló élősejtszám meghatározása. A kontrollvizsgálatokat a sejtszuszpenziók kezelésének megkezdése előtt a 3.7.3. pont szerint végeztük.
3.7.5. Minták kezelése
Ismert kiinduló sejtkoncentrációjú sejtszuszpenziókból végeztük az ultrahangkezeléseket 25ml mintánkénti kezelt mennyiségekkel. Az 1, 2, 3, 5, 8 és 15 percen keresztül kezelt, 25ml mennyiségű mintákból 1ml mennyiséget vettünk ki Plate Count táptalajos csíráztatásra, vagyis élősejtszám meghatározásra, a milliliterenkénti túlélő csíraszám vizsgálatokhoz. A kezeléseket csak úgy lehetett kivitelezni a 3.5. kísérletsorozattal való azonosság miatt, hogy ha sarzsokat képeztünk és ellenőrzötten azonos kiinduló élősejtszámú mintákból indultunk ki, az adott mintavételi időpillanatban leállítottuk a kezelést, a rendszert ismét előkészítettük, majd újra kezeltük az előzővel megegyező kiinduló csíraszámú és élősejtszámú mintát, most már a következő mintavételi időpillanatig és így tovább a kívánt maximális kezelési időintervallumig. Erre azért volt szükség, mert minden mintavételi időpillanatban 1ml mintamennyiséget távolítottunk el a kezelt anyagból a mikroorganizmus törzs kicsíráztatásának céljára. Emiatt az eredeti 25ml kezelt mennyiségből a következő időpillanatig eltelt időintervallumon már nem lettek volna azonosak a kísérleti körülmények a 3.5. kísérletsorozattal, mivel ott 0,05ml-es mintamennyiségek mintánkénti kivételével nem befolyásoltuk nagymértékben a hangteret.
A vizsgálatokat a 3.5.4. pontban feltüntetett, élesztőgombára vonatkozó kavitációs határkoncentráció értékek többszörös mennyiségeinek megfelelő csíra/ml koncentrációkkal, 9 és 6W/cm2 ultrahang teljesítményeken végeztük úgy, hogy az öt különböző sejtkoncentrációnál 9W/cm2 teljesítménnyel és a legalacsonyabb és legmagasabb sejtkoncentrációknál 6W/cm2 teljesítménnyel is elvégeztük a kezeléseket.
3.8. Az ultrahang szelektív sejtbiológiai hatása
Végső vizsgálatként a Saccharomyces cerevisiae élesztőgomba és a Pseudomonas aeruginosa baktérium esetében összevetettük a túlélési- és rezisztenciagörbéket, az alkalmazott teljesítmények és a koncentrációk függvényében, majd felrajzoltuk a rezisztenciasíkokat és meghatároztuk a szelektív ultrahanghatás kritériumait egy fajon belül és a fajok között.